最新產品
Product
佛山市口罩检测中心
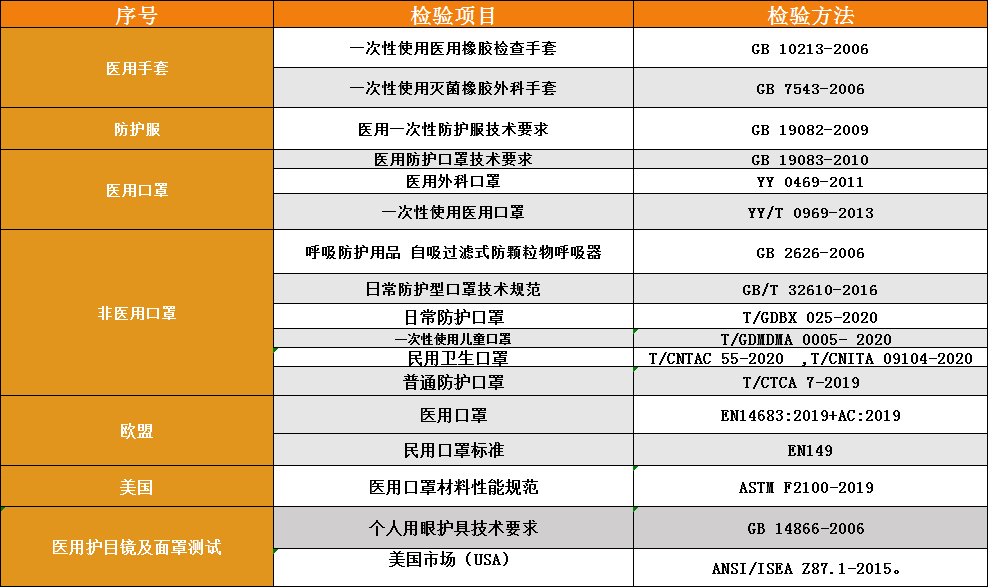
<一>欧盟市场
欧洲市场对于口罩的管理分两个主要区别:个人防护口罩和医用口罩。个人防护口罩主要是工业防护,医用口罩主要是医院使用。
1.医用口罩
医用口罩对应的欧洲标准是EN14683,该标准按照BFE、呼吸阻抗和防喷溅能力分为三个类别:Type I、Type II、Type IIR.
按照欧洲医疗法规2017/745/EU的要求,口罩可以按照一类器械管理。依据产品是无菌或非无菌状态提供,起认证模式不一样
(1)非无菌:走自我符合性声明的路径,无需公告机构审核,办理流程如下:
a.编写CE MDR技术文档;
b.找欧盟授权代表;
c.编制DOC; 做欧洲的产品注册。
(2)无菌:口罩和防护服如是无菌,在欧盟是Is的产品,办理流程如下:
a.建立ISO13485质量管理体系;
b.编写CE MDR技术文档;
c.找欧盟授权代表;
d.取得公告机构颁发的ISO13485证书和CE证书。
2.防护口罩
防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2/FFP3三个类别。防护口罩需要满足欧盟个人设备指令(PPE)的要求,防护口罩属于其中复杂设计的产品。出口欧盟需要授权的公告机构进行认证和颁发证书,认证需要的资料包括:
(1)产品的型式实验报告
(2)技术文件评审
(3)工厂质量体系
<二>美国市场
美国法规对医用口罩和工业防护口罩同样是区分管理,其中医用口罩由FDA管控,而防护口罩则由NIOSH管控。
1.医用口罩
美国对于医用口罩的管理机构是FDA,在FDA系统中对于口罩的分类有:外科口罩、儿科口罩、带有抗菌/抗病毒介质的外科口罩。 医用口罩的分类都是II类,都需要申请510K批准。那么正常出口美国的口罩路径为:
(1)进行产品测试(性能测试、生物学测试)
(2)准备510K文件,提示FDA审核
(3)FDA发510K批准信
(4)完成工厂注册和器械列名
(5)产品出口
其过程至少需要半年以上时间。还有其他两种其他可选途径:I.已经获得NIOSH批准的N95口罩可以直接注册,需要的条件是生物学测试、阻燃测试和血液穿透测试都通过,那么可以豁免510K,直接进行工厂注册和器械列名;II.获得持有510K的制造商的授权,作为其代工厂使用其510K批准号进行企业注册和器械列名。
2.防护口罩
NIOSH将口罩分成N95、N99、N100、R95、R99、R100、P95、P99、P100合计9个类别。
NIOSH 的口罩防护等级认证程序复杂,包括:
1)送样品到NIOSH认可的实验室进行测试
2)编写技术文件提交NIOSH审评,通常包括:产品图纸、产品说明、质量体系文件、测试报告
3)工厂检查
4)核发证书

